美国食品药品管理局(FDA)在2023年12月8日首次审批通过一项基因编辑疗法(Casgevy),用于治疗镰状细胞病(sickle cell disease,又称镰状红血球贫血症,一种由于单一基因变异导致的血液疾病,患者的血红蛋白出现异常,导致严重的疼痛、贫血等问题,大约50%的患者在50岁前死亡)。FDA预计有2万名患者可以适用这一新疗法,但绝大多数医院尚无法进行此项治疗,能提供治疗的医院每年预计也只能治疗个位数患者。
CRISPR是自然存在的细胞防御机制
CRISPR是细菌用来抵御噬菌体病毒等外来入侵的一种防御机制,主要包括两个部分:小段DNA序列(CRISPR),以及可以切开DNA的特殊蛋白质(Cas蛋白质,CRISPR associated proteins)。


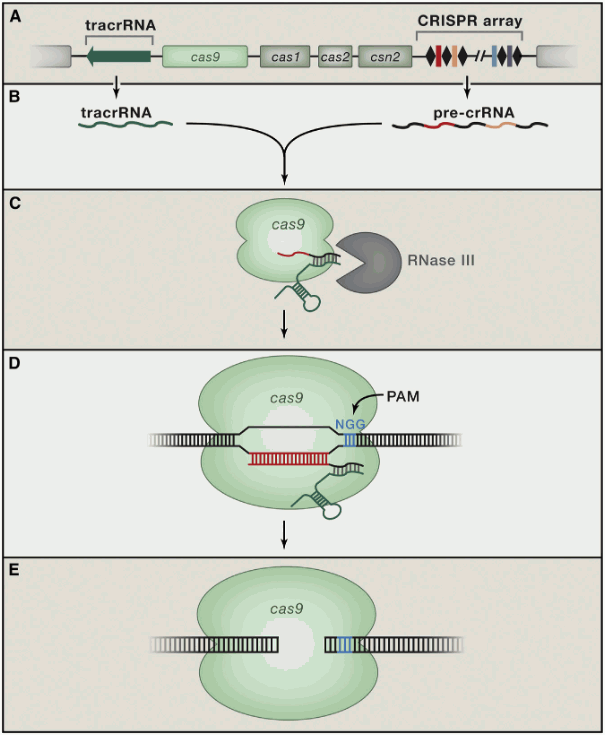
CRISPR在细胞中的工作流程
- 取样:当病毒入侵细菌时,Cas蛋白质就会将病毒DNA切下一段,加入CRISPR,再被复制成小段RNA,和Cas蛋白质绑定;
- 监测:有了病毒样本的Cas蛋白质,会在细菌内部“巡逻”,发现自由活动的遗传物质(例如入侵的病毒),便会与自身的基因片段进行对比;
- 摧毁:如果对比一致,Cas蛋白质就会切碎入侵病毒。

CRISPR可以被用于编辑基因
在CRISPR之前,也有其他基因编辑工具,但准确度和效率都极低。2012年,科学家成功在实验室中设计出了“引导RNA”(guide RNA),并将其附着到链球菌中的Cas蛋白质,最终成为具备DNA切割能力的系统。
仅仅切割还不够。基因被切割后,细胞有两种方式进行修复:
- non-homologous end joining(非同源性末端接合):直接连结断裂两端,但很容易出错而导致基因失效;
- homology directed repair(同源引导修复):然而,如果在切割同时,由Cas蛋白质提供修复样板,新的基因序列可以被插入断裂的基因。
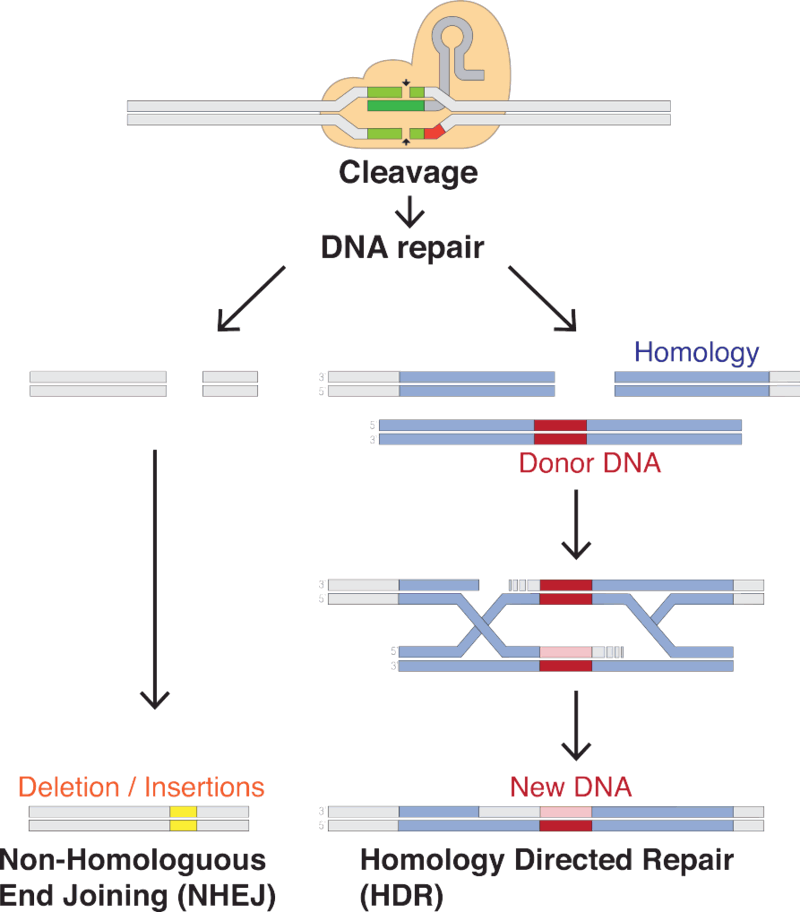
因此,CRISPR可以“杀死”基因,也可以编辑基因。由于CRISPR可以定位单个分子,它甚至还可以作为基因检测工具等,实现其他目的。
CRISPR除了治疗疾病,还有其他广泛用途
诺贝尔奖得主Jennifer Doudna表示,CRISPR不仅可以用来编辑单个基因,还可以编辑人或其他动物体内的微生物群,将有望帮助治疗阿尔茨海默症、哮喘、肠应激综合征等疾病,或是降低畜牧业中牛羊等动物排出的温室气体量。
CRISPR的编辑能力不只局限于哺乳动物。所以,除了治疗人类疾病外,CRISPR还可以用来提高农作物产量、生成无法传播疟疾的蚊虫等。例如,华中农业大学团队在2023年6月再《Nature》杂志发表论文,在不降低产量的前提下,通过基因编辑提升了水稻的广谱抗病能力,包括对稻瘟病(rice blast)等严重感染的抵御能力。
局限性
尽管如此,CRISPR有其局限性,例如:准确性、编辑效率等。此外,这一技术牵扯大量道德风险,尤其是涉及对生殖细胞的编辑可能对后代造成不可控的影响。
来源
- 视频:
- 文章、论文等: